| Navegación |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

|
|
|
|
| |
ACIDOS Y BASES.
ACIDO: Un ácido (del latín acidus, que significa agrio) es considerado tradicionalmente como cualquier compuesto químico que, cuando se disuelve en agua, produce una solución con una actividad de catión hidronio mayor que el agua pura, esto es, un pH menor que 7. Esto se aproxima a la definición moderna de Johannes Nicolaus Brønsted y Martin Lowry, quienes definieron independientemente un ácido como un compuesto que dona un catión hidrógeno (H+) a otro compuesto (denominado base).Los ácidos pueden existir en forma de sólidos, líquidos o gases, dependiendo de la temperatura. También pueden existir como sustancias puras o en solución.
A las sustancias químicas que tienen la propiedad de un ácido se les denomina ácidas.
PROPIEDADES DE LOS ACIDOS:
- Tienen sabor ácido como en el caso del ácido cítrico en la naranja y el limón.
- Cambian el color del papel tornasol azul a rosa, el anaranjado de metilo de anaranjado a rojo y deja incolora a la fenolftaleína.
- Son corrosivos.
- Producen quemaduras de la piel.
- Son buenos conductores de electricidad en disoluciones acuosas.
- Reaccionan con metales activos formando una sal e hidrógeno.
- Reaccionan con bases para formar una sal mas agua.
- Reaccionan con óxidos metálicos para formar una sal mas agua.
ÁCIDOS DE ARRHENIUS:
El químico sueco Svante Arrhenius fue el primero en atribuir las propiedades de acidez al hidrógeno en 1884. Un ácido de Arrhenius es una sustancia que aumenta la concentración de catión hidronio, H3O+, cuando se disuelve en agua. Esta definición parte del equilibrio de disociación del agua en hidronio e hidróxido:
- H2O(l) + H2O (l)
 H3O+(ac) + OH-(ac) H3O+(ac) + OH-(ac)
- ÁCIDOS DE BRONSTED-LOWRY:
-
En 1923, los químicos Johannes Nicolaus Brønsted y Thomas Martin Lowry reconocieron independientemente que las reacciones ácido-base involucran la transferencia de un protón. Un ácido de Brønsted-Lowry es una especie que dona un protón a una base de Brønsted-Lowry. La teoría ácido-base de Brønsted-Lowry tiene varias ventajas sobre la teoría de Arrhenius. Considere las siguientes reacciones del ácido acético (CH3COOH), el ácido orgánico que le da al vinagre su sabor característico:

Las siguientes reacciones ilustran las limitaciones de la definición de Arrhenius:
1.) H3O+(ac) + Cl-(ac) + NH3 → Cl-(ac) + NH+4(aq)
2.) HCl(benceno) + NH3(benceno) → NH4Cl(s)
3.) HCl(g) + NH3(g) → NH4Cl(s)
ÁCIDO DE LEWIS:
Un tercer concepto fue propuesto por Gilbert N. Lewis, el cual incluye reacciones con características ácido-base que no involucran una transferencia de protón. Un ácido de Lewis es una especie que acepta un par de electrones de otra especie; en otras palabras, es un aceptor de par de electrones. Las reacciones ácido-base de Brønsted son reacciones de transferencia de protones, mientras que las reacciones ácido-base de Lewis son transferencias de pares de electrones. Todos los ácidos de Brønsted son también ácidos de Lewis, pero no todos los ácidos de Lewis son ácidos de Brønsted. Las siguientes reacciones podrían ser descritas en términos de química ácido-base.


BASES: Una base es, en primera aproximación, según Arrhenius, cualquier sustancia que en disolución acuosa aporta iones OH− al medio. Un ejemplo claro es el hidróxido potásico, de fórmula KOH:
KOH → OH− + K+ (en disolución acuosa)
Los conceptos de base y ácido son contrapuestos. Para medir la basicidad (o alcalinidad) de un medio acuoso se utiliza el concepto de pOH, que se complementa con el de pH, de forma tal que pH + pOH = pKw, (Kw en CNPT es igual a 10−14). Por este motivo, está generalizado el uso de pH tanto para ácidos como para bases.
PROPIEDADES DE LAS BASES:
- Poseen un sabor amargo característico.
- Sus disoluciones conducen la corriente eléctrica.
- Azulean el papel de tornasol.
- Reaccionan con los ácidos (neutralizándolos).
- La mayoría son irritantes para la piel.
- Tienen un tacto jabonoso.
- Se pueden disolver.
- Sus átomos se rompen con facilidad.
- Son inflamables.
FUERZA DE UNA BASE:
Una base fuerte es la que se disocia completamente en el agua, es decir, aporta el máximo número de iones OH−. El hidróxido potásico es un ejemplo de una base fuerte.
Una base débil también aporta iones OH− al medio, pero está en equilibrio el número de moléculas disociadas con las que no lo están.

En este caso, el hidróxido de aluminio está en equilibrio (descomponiéndose y formándose) con los iones que genera.
FORMACIÓN DE UNA BASE:
Una base se forma cuando un óxido de un metal reacciona con agua:
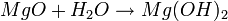
igual es:
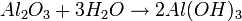
|
|
|
|
|
|
| |
Hoy habia 1 visitantes (3 clics a subpáginas) ¡Aqui en esta página! |
|
|
|
|
|
|
|